Θειοκυανιούχο Κάλιο 250g
€30,00 με Φ.Π.Α
Θειοκυανιούχο κάλιο 250g
Potassium thiocyanate, Potassium sulfocyanate, Potassium isothiocyanate, Potassium thiocyanide, Potassium rhodanide
KSCN
M.W: 97.181 g mol−1
CAS Registry Number: 333-20-0
https://pubchem.ncbi.nlm.nih.gov/compound/Potassium-thiocyanate
Θειοκυανιούχο Κάλιο 250g
Θειοκυανιούχο Κάλιο 250g
Το θειοκυανικό κάλιο είναι η χημική ένωση με τον μοριακό τύπο KSCN. Είναι ένα σημαντικό άλας του θειοκυανικού ανιόντος, ενός από τα ψευδοαλογοναρίδια. Η ένωση έχει χαμηλό σημείο τήξης σε σχέση με τα περισσότερα άλλα ανόργανα άλατα.
Φυσικοχημικές Ιδιότητες
Μοριακός Τύπος: KSCN
Μοριακή μάζα: 97.181 g mol−1
Εμφάνιση: Άχρωμοι κρύσταλλοι
Πυκνότητα: 1.886 g/cm3
Σημείο τήξης: 173.2 °C
Σημείο ζέσης: 500 °C
Διαλυτότητα στο νερό: 177 g/100 mL (0 °C)
217 g/100 mL (20 °C)
Διαλυτότητα: διαλυτό σε αιθανόλη και ακετόνη
Χημική Δομή
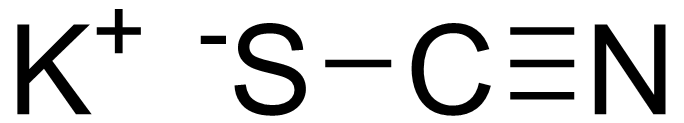
Ασφάλεια και αποθήκευση


Αναλυτική Περιγραφή
Το υδατικό KSCN αντιδρά σχεδόν ποσοτικά με Pb (NO3) 2 για να δώσει Pb (SCN) 2, το οποίο έχει χρησιμοποιηθεί για να μετατρέψει ακυλοχλωρίδια σε ισοθειοκυανικά.
Το KSCN μετατρέπει το ανθρακικό αιθυλένιο σε αιθυλενοσουλφίδιο. Για το σκοπό αυτό, το KSCN αρχικά τήκεται υπό κενό για την απομάκρυνση του νερού. Σε μια σχετική αντίδραση, το KSCN μετατρέπει κυκλοεξανοξείδιο στο αντίστοιχο επιστίδιο.
C6H10O + KSCN → C6H10S + KOCN
Το KSCN είναι επίσης το αρχικό προϊόν για τη σύνθεση του καρβονυλοσουλφιδίου.
Το αραιό υδατικό KSCN χρησιμοποιείται περιστασιακά για μέτρια ρεαλιστικά αποτελέσματα αίματος στην ταινία και το θέατρο. Μπορεί να βαφτεί σε επιφάνεια ή να διατηρηθεί ως άχρωμο διάλυμα. Όταν έρχεται σε επαφή με το διάλυμα χλωριούχου σιδήρου (ή με άλλα διαλύματα που περιέχουν Fe3 +), το προϊόν της αντίδρασης είναι ένα διάλυμα με ένα ερυθρό χρώμα αίματος, λόγω του σχηματισμού του ιόντος συμπλόκου θειοκυανταδίου. Έτσι, αυτό το χημικό χρησιμοποιείται συχνά για να δημιουργήσει την επίδραση των «στιγματών». Επειδή και οι δύο λύσεις είναι άχρωμες, μπορούν να τοποθετηθούν ξεχωριστά σε κάθε χέρι. Όταν τα χέρια έρχονται σε επαφή, οι λύσεις αντιδρούν και το αποτέλεσμα φαίνεται σαν τα στίγματα.
Ομοίως, αυτή η αντίδραση χρησιμοποιείται ως δοκιμασία για το Fe3 + στο εργαστήριο.






 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Labdisc
Labdisc Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Έπιπλα Εργαστηρίου
Έπιπλα Εργαστηρίου Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB & MBL & Wireless Αισθητήρες
USB & MBL & Wireless Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley – Kitt
Botley – Kitt Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Ρομπότ Τηλεπαρουσίασης
Ρομπότ Τηλεπαρουσίασης DOBOT
DOBOT VR Τεχνολογικά
VR Τεχνολογικά Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Makerzoid
Makerzoid Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones